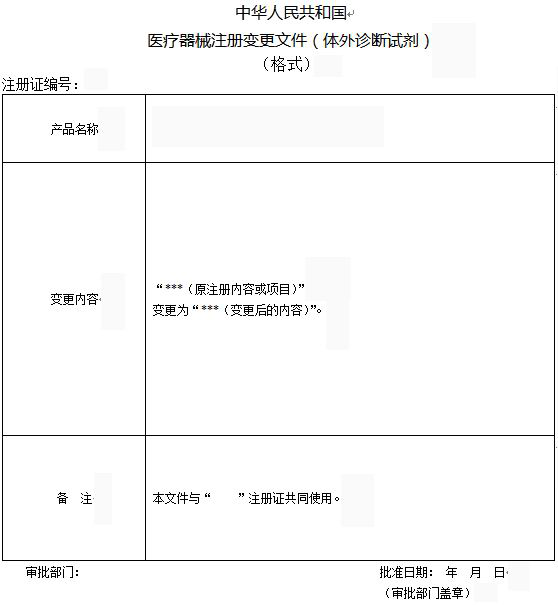
三類體外診斷試劑變更注冊
變更抗原、抗體等主要材料的供應商,應當提交下列資料:變更后抗原
- 立即咨詢
-
全國服務熱線:
400-888-7587
? 辦理條件 / Conditions
申請人應為境內(nèi)依法進行登記的企業(yè)
政府官方原文鏈接:
http://samr.cfda.gov.cn/WS01/CL1768/152059.html
? 申請材料清單 / List of application materials
1.申請表
2.證明性文件
(1)企業(yè)營業(yè)執(zhí)照副本復印件。
(2)組織機構(gòu)代碼證復印件
3.注冊人關于變更情況的聲明
(1)變更的原因及目的說明
(2)變更可能對產(chǎn)品性能產(chǎn)生影響的技術分析。
(3)與產(chǎn)品變化相關的產(chǎn)品風險分析資料
4.原醫(yī)療器械注冊證及其附件復印件、歷次醫(yī)療器械注冊變更文件復印件
5.具體變更情況的其他技術資料要求
(1)變更抗原
(2)變更檢測條件
、陽性判斷值或參考區(qū)間,應當提交下列資料:變更后的檢測條件、陽性判斷值或參考區(qū)間確定的詳細試驗資料;臨床試驗資料;變更前、后的產(chǎn)品技術要求、產(chǎn)品說明書。(3)變更產(chǎn)品儲存條件和/或有效期,應當提交下列資料:有關產(chǎn)品穩(wěn)定性研究的試驗資料
;變更前、后的產(chǎn)品技術要求、產(chǎn)品說明書及標簽樣稿。(4)修改產(chǎn)品技術要求
,但不降低產(chǎn)品有效性的變更(5)對產(chǎn)品說明書和/或產(chǎn)品技術要求中文字的修改
(6)變更包裝規(guī)格
(7)變更適用機型
,應當提交下列資料:采用新的適用機型進行分析性能評估的試驗資料;提供變更前、后的產(chǎn)品技術要求、產(chǎn)品說明書和標簽樣稿(如涉及)。(8)增加臨床適應癥的變更
,應當提交下列資料:針對增加的臨床適應癥所進行的分析性能評估資料(如涉及);針對增加的臨床適應癥所進行的臨床試驗資料;變更前、后的產(chǎn)品技術要求、產(chǎn)品說明書。(9)增加臨床測定用樣本類型的變更
,應當提交下列資料:采用增加的臨床測定樣本類型與已批準的樣本類型進行比對的臨床試驗資料,如增加的樣本類型與原批準的樣本類型無直接可比性,可以選擇與樣本類型具可比性的已上市同類產(chǎn)品進行比對的臨床試驗;變更前、后的產(chǎn)品技術要求、產(chǎn)品說明書。(10)其他可能影響產(chǎn)品有效性的變更
,根據(jù)變更情況提供有關變更的試驗資料。(11)應當根據(jù)產(chǎn)品具體變更情況,提交該變更對產(chǎn)品性能可能產(chǎn)生的影響進行驗證的試驗資料(如涉及)
。6.符合性聲明
(1)注冊人聲明本產(chǎn)品符合《體外診斷試劑注冊管理辦法》和相關法規(guī)的要求
;聲明本產(chǎn)品符合現(xiàn)行國家標準、行業(yè)標準,并提供符合標準的清單。(2)所提交資料真實性的自我保證聲明。
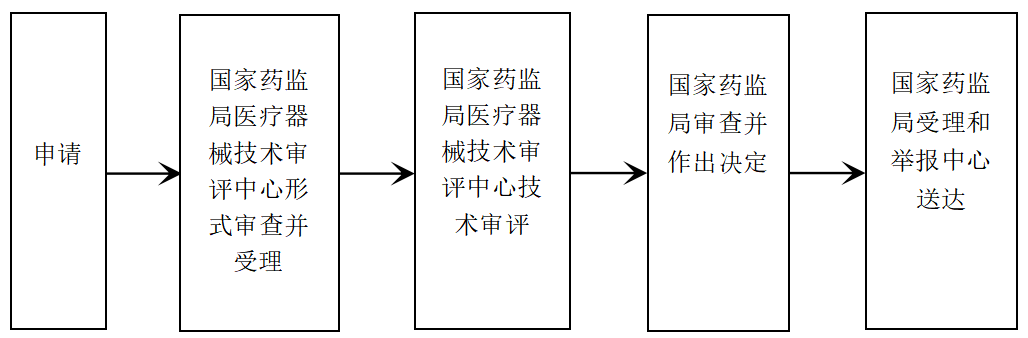
? 辦理流程 / Processing process
? 廣東政務局服務承諾時間 / Service Commitment Time of Guangdong Government Bureau
名稱 | 解釋說明 | 時限 |
受理 | 5(工作日) | |
行政許可決定 | 20個工作日(不含技術審評和申請人補充資料及補充資料審評所需的時間)。20個工作日內(nèi)不能做出決定的,經(jīng)局領導批準,可延長10個工作日。 | 20(工作日) |
? 辦理依據(jù) / Processing basis
《醫(yī)療器械監(jiān)督管理條例》(國務院令第650號)第十四條:已注冊的第二類 、第三類醫(yī)療器械產(chǎn)品,其設計、原材料 、生產(chǎn)工藝、適用范圍、使用方法等發(fā)生實質(zhì)性變化,有可能影響該醫(yī)療器械安全、有效的,注冊人應當向原注冊部門申請辦理變更注冊手續(xù);發(fā)生非實質(zhì)性變化,不影響該醫(yī)療器械安全、有效的,應當將變化情況向原注冊部門備案。 | 《國家食品藥品監(jiān)督管理總局關于調(diào)整部分醫(yī)療器械行政審批事項審批程序的決定》(局令第32號):將下列由國家食品藥品監(jiān)督管理總局作出的醫(yī)療器械行政審批決定 ,調(diào)整為由國家食品藥品監(jiān)督管理總局醫(yī)療器械技術審評中心以國家食品藥品監(jiān)督管理總局名義作出:一、第三類高風險醫(yī)療器械臨床試驗審批決定 ;二 、國產(chǎn)第三類醫(yī)療器械和進口醫(yī)療器械許可事項變更審批決定;三 、國產(chǎn)第三類醫(yī)療器械和進口醫(yī)療器械延續(xù)注冊審批決定。其他醫(yī)療器械注冊申請的審批決定,按現(xiàn)程序 ,由國家食品藥品監(jiān)督管理總局作出。 |
? 金飛鷹相關服務 / Golden Eagle related services
●變更條件確認 ●產(chǎn)品分類確定或分類申請 ●創(chuàng)新產(chǎn)品申報 ●產(chǎn)品技術要求確定 ●廠房規(guī)劃及平面圖設計 ●廠房設施驗證 ●產(chǎn)品設計驗證 | ●產(chǎn)品工藝驗證 ●產(chǎn)品樣品送檢資料準備 ●豁免臨床試驗產(chǎn)品臨床驗證 ●不豁免臨床試驗產(chǎn)品臨床試驗CRO ●臨床試驗方案備案 ●產(chǎn)品注冊資料準備 ●產(chǎn)品注冊資料遞交 | ●生產(chǎn)現(xiàn)場車間GMP文件編制 ●產(chǎn)品SOP文件編制 ●體系考核輔導與培訓 ●相關生產(chǎn)與檢驗設備 、車間環(huán)境檢驗儀器等確定●GMP體系考核前的預檢查 ●GMP體系考核后的不符合項改善 ●注冊證進度跟蹤 |
? 結(jié)果樣本 / Results the sample
五大專屬優(yōu)勢一站式解決您的問題
全面解決您的研發(fā)、生產(chǎn)
、驗收、營銷全流程問題
實戰(zhàn)經(jīng)驗
practical experience
2000多個二、三類醫(yī)械項目經(jīng)驗沉淀
,為你分配做過相同案例的實戰(zhàn)老師。專業(yè)翻譯
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經(jīng)驗
,能準確翻譯專業(yè)名詞及用語軟件開發(fā)
Software development
強大的軟件研發(fā)團隊,已為集團研發(fā)出成熟的項目管理軟件
集團供應鏈
Group supply chain
嚴選數(shù)十個優(yōu)秀的醫(yī)械行業(yè)服務機構(gòu),可為客戶推薦更實惠的醫(yī)械配套服務
百家企業(yè)10年長期信賴金飛鷹
多次創(chuàng)造二三類高風險產(chǎn)品一次性通過的行業(yè)紀錄
深圳華大基因研究院
項目狀態(tài):已結(jié)案
項目輔導老師:李老師
深圳市沃爾德外科醫(yī)療器械技術有限公司
項目狀態(tài):已結(jié)案
項目輔導老師:車老師
深圳/江蘇邁動醫(yī)療設備有限公司
項目狀態(tài):已結(jié)案
項目輔導老師:王老師
江蘇無錫蕾明視康科技有限公司
項目狀態(tài):已結(jié)案
項目輔導老師:黃老師
電話
400-888-7587
0755-86194173、13502837139
020-82177679
微信

微信公眾

小程序
郵箱
617677449@qq.com