專注國(guó)內(nèi)外醫(yī)療器械咨詢服務(wù)
注冊(cè)認(rèn)證 · 許可備案 · 體系輔導(dǎo) · 企業(yè)培訓(xùn)
400-888-7587
0755-86194173
020-82177679、13602603195
四川:028-68214295、15718027946
湖南:0731-22881823
、15013751550列表
加拿大衛(wèi)生部正式啟動(dòng)第二輪eSTAR試點(diǎn)
文章出處:法規(guī)動(dòng)態(tài) 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2025-08-26
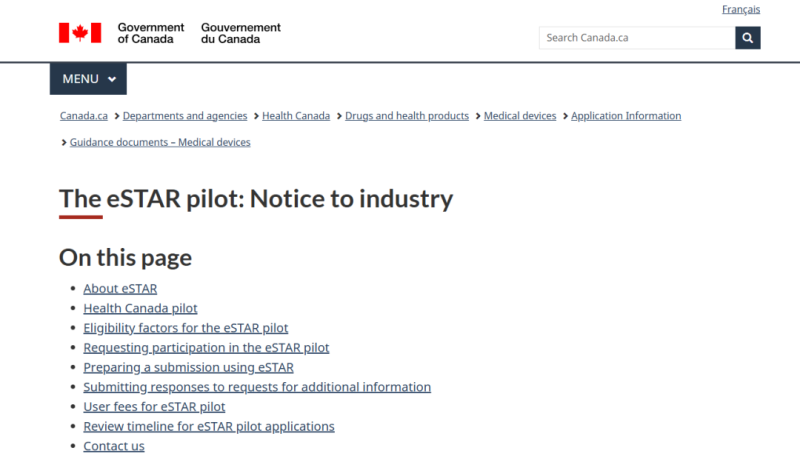
近日,加拿大衛(wèi)生部發(fā)布通知稱,加拿大衛(wèi)生部正在啟動(dòng)第二個(gè)試點(diǎn),擴(kuò)大提交類型的范圍。根據(jù)該試點(diǎn)計(jì)劃,醫(yī)療器械制造商在申請(qǐng)Ⅲ類或 IV 類設(shè)備的新的或重大變更修改時(shí),可以用eSTAR提交,包括體外診斷設(shè)備 (IVDDs) 和非體外診斷設(shè)備 (non-IVDDs)。作為試點(diǎn)的一部分 ,參與者還將測(cè)試旨在將內(nèi)容轉(zhuǎn)換為 IMDRF 目錄文件夾結(jié)構(gòu)的轉(zhuǎn)換工具 。
由于第一次試點(diǎn)范圍不包含IVDDs(in vitro diagnostic devices),本次IVDD的eSTAR試點(diǎn)申請(qǐng)將得到優(yōu)先考慮 。
企業(yè)具備以下條件即可申請(qǐng)參加此次試點(diǎn):
必須準(zhǔn)備好在 2025 自然年年底之前向加拿大衛(wèi)生部提交Ⅲ類或 IV 類設(shè)備的新的或重大變更申請(qǐng)
醫(yī)療器械不得是組合產(chǎn)品
必須準(zhǔn)備好eSTAR相關(guān)文件
延伸閱讀 關(guān)于eSTAR
eSTAR是The electronic Submission Template And Resource的首字母縮寫(xiě) ,是由美國(guó)食品和藥物管理局開(kāi)發(fā)的交互式 PDF 表格,用于指導(dǎo)申請(qǐng)人完成準(zhǔn)備綜合醫(yī)療器械提交的過(guò)程 。該模板包含以下功能:
自動(dòng)化(例如 ,表單構(gòu)建和自動(dòng)填充)內(nèi)容和結(jié)構(gòu)與國(guó)際醫(yī)療器械監(jiān)管機(jī)構(gòu)論壇 (IMDRF) 制定的體外診斷醫(yī)療器械監(jiān)管提交目錄(第 4 版)和非體外診斷設(shè)備監(jiān)管提交目錄(第 4 版)文件相匹配
集成多個(gè)資源(例如,指南和數(shù)據(jù)庫(kù))
每個(gè)提交部分的指導(dǎo)構(gòu)建
自動(dòng)驗(yàn)證
指導(dǎo)申請(qǐng)人幫助確保他們提供提交所需的詳細(xì)信息
作為綜合資源,整合提交準(zhǔn)備所需的必要信息和鏈接
美國(guó)FDA目前已對(duì)eSTAR提交做出了硬性要求,如:自2023年10月1日起,所有510(k) 遞交文件(除非獲得豁免),必須使用eSTAR電子文檔形式遞交;自2025年10月1日起,De Novo申請(qǐng)需使用eSTAR進(jìn)行提交。
往期精彩推薦
,搶占先機(jī)!" data-itemshowtype="0" linktype="text" data-linktype="2" style="-webkit-tap-highlight-color: rgba(0, 0, 0, 0); margin: 0px; padding: 0px; outline: 0px; text-decoration-line: none; -webkit-user-drag: none; cursor: default; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important;">吐血整理丨全國(guó)多地銀發(fā)經(jīng)濟(jì)政策匯總:一鍵收藏,搶占先機(jī)!
,醫(yī)械企業(yè)的掘金機(jī)會(huì)" data-itemshowtype="0" linktype="text" data-linktype="2" style="-webkit-tap-highlight-color: rgba(0, 0, 0, 0); margin: 0px; padding: 0px; outline: 0px; text-decoration-line: none; -webkit-user-drag: none; cursor: default; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important;">銀發(fā)經(jīng)濟(jì)”風(fēng)口下,醫(yī)械企業(yè)的掘金機(jī)會(huì)? 沙特注冊(cè)“再下一城”!本期產(chǎn)品:脫毛儀
? 重磅發(fā)布!2025年第二次醫(yī)療器械分類界定結(jié)果出爐
? 最新發(fā)布→從1025到1047!免臨床評(píng)價(jià)醫(yī)療器械范圍再擴(kuò)大
醫(yī)療器械注冊(cè)咨詢認(rèn)準(zhǔn)金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139

近日,加拿大衛(wèi)生部發(fā)布通知稱,加拿大衛(wèi)生部正在啟動(dòng)第二個(gè)試點(diǎn),擴(kuò)大提交類型的范圍。根據(jù)該試點(diǎn)計(jì)劃,醫(yī)療器械制造商在申請(qǐng)Ⅲ類或 IV 類設(shè)備的新的或重大變更修改時(shí),可以用eSTAR提交,包括體外診斷設(shè)備 (IVDDs) 和非體外診斷設(shè)備 (non-IVDDs)。作為試點(diǎn)的一部分 由于第一次試點(diǎn)范圍不包含IVDDs(in vitro diagnostic devices),本次IVDD的eSTAR試點(diǎn)申請(qǐng)將得到優(yōu)先考慮 企業(yè)具備以下條件即可申請(qǐng)參加此次試點(diǎn): 必須準(zhǔn)備好在 2025 自然年年底之前向加拿大衛(wèi)生部提交Ⅲ類或 IV 類設(shè)備的新的或重大變更申請(qǐng) 醫(yī)療器械不得是組合產(chǎn)品 必須準(zhǔn)備好eSTAR相關(guān)文件 eSTAR是The electronic Submission Template And Resource的首字母縮寫(xiě) 自動(dòng)化(例如 內(nèi)容和結(jié)構(gòu)與國(guó)際醫(yī)療器械監(jiān)管機(jī)構(gòu)論壇 (IMDRF) 制定的體外診斷醫(yī)療器械監(jiān)管提交目錄(第 4 版)和非體外診斷設(shè)備監(jiān)管提交目錄(第 4 版)文件相匹配 集成多個(gè)資源(例如,指南和數(shù)據(jù)庫(kù)) 每個(gè)提交部分的指導(dǎo)構(gòu)建 自動(dòng)驗(yàn)證 指導(dǎo)申請(qǐng)人幫助確保他們提供提交所需的詳細(xì)信息 作為綜合資源,整合提交準(zhǔn)備所需的必要信息和鏈接 美國(guó)FDA目前已對(duì)eSTAR提交做出了硬性要求,如:自2023年10月1日起,所有510(k) 遞交文件(除非獲得豁免),必須使用eSTAR電子文檔形式遞交;自2025年10月1日起,De Novo申請(qǐng)需使用eSTAR進(jìn)行提交。 ? 沙特注冊(cè)“再下一城”!本期產(chǎn)品:脫毛儀 ? 重磅發(fā)布!2025年第二次醫(yī)療器械分類界定結(jié)果出爐 ? 最新發(fā)布→從1025到1047!免臨床評(píng)價(jià)醫(yī)療器械范圍再擴(kuò)大 醫(yī)療器械注冊(cè)咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052 重慶:135-0283-7139
相關(guān)新聞
了解更多 +- 常用查詢:
- 俄羅斯官網(wǎng) ANVISA 加拿大官網(wǎng) 日本厚生勞動(dòng)省 更多國(guó)外查詢>> 中華人民共和國(guó)香港特別行政區(qū)政府 中國(guó)臺(tái)灣 中國(guó)醫(yī)療器械信息網(wǎng) 中華人民共和國(guó)國(guó)家衛(wèi)生健康委員會(huì) 廣東省衛(wèi)生和計(jì)劃生育委員會(huì) 廣東省藥品不良反應(yīng)監(jiān)測(cè)中心 廣東省質(zhì)量技術(shù)監(jiān)督局 廣州市食品藥品監(jiān)督管理局 深圳市行政服務(wù)大廳 更多國(guó)內(nèi)查詢>>
電話
400-888-7587
0755-86194173
020-82177679
微信

微信公眾

小程序
郵箱
617677449@qq.com
