專注國內(nèi)外醫(yī)療器械咨詢服務(wù)
注冊認證 · 許可備案 · 體系輔導(dǎo) · 企業(yè)培訓(xùn)
400-888-7587
0755-86194173
020-82177679
四川:028-68214295
湖南:0731-22881823
列表
新冠抗原試劑“一盒難求”!其注冊審查要點都有哪些
連日來 ,全國各地紛紛出臺新政策 ,對新冠肺炎疫情防控措施進行調(diào)整,在諸多場所取消對查驗核酸陰性證明的要求 ,由此 ,抗原檢測試劑需求呈現(xiàn)上升趨勢,多地開始試行抗原自測 ,如廣州衛(wèi)健委提出“鼓勵家庭自備抗原試劑盒” 。在此情形下,部分地區(qū)表示“一盒難求” 。
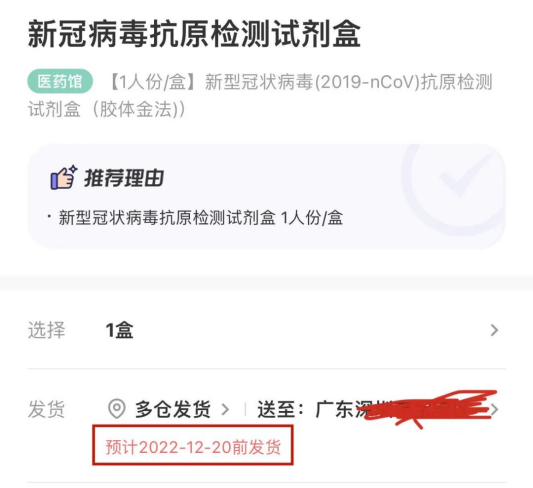
這里提到的抗原試劑盒 ,全名叫“新型冠狀病毒(2019-nCoV)抗原檢測試劑盒”。我們在國家藥監(jiān)局官網(wǎng)搜索顯示 ,截至目前,國家藥監(jiān)局已批準的新冠病毒抗原檢測試劑產(chǎn)品共有33款。
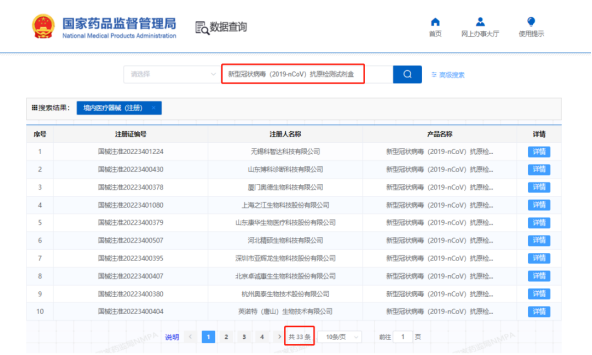
? 圖源:國家藥監(jiān)局官網(wǎng)
目前列表里的產(chǎn)品都是通過應(yīng)急審批的方式投入市場的,據(jù)國家藥監(jiān)局2021年12月發(fā)布的《醫(yī)療器械應(yīng)急審批程序》第十四條:“對于應(yīng)急審批醫(yī)療器械,附條件批準上市的,醫(yī)療器械注冊證的有效期與注冊證注明的附帶條件的完成時限一致,原則上不超過1年。如注冊人完成附帶條件,可以在到期之日前申請辦理延續(xù)注冊,符合要求的給予延續(xù)注冊,注冊證有效期為5年?div id="4qifd00" class="flower right">
!?/span>
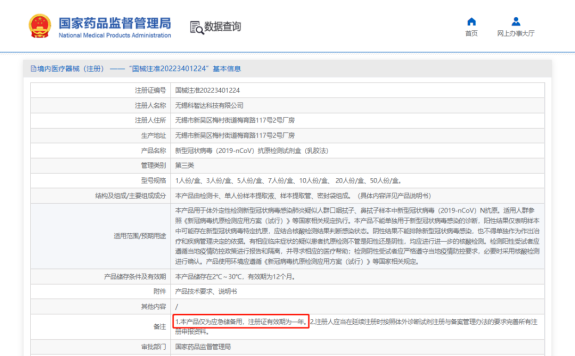
? 點開注冊證詳情,備注欄里有“注冊證有效期為一年”的說明
接下來,通過新冠抗原試劑盒進行居家健康監(jiān)測也許會成為常態(tài),今天,我們就來聊一聊新型冠狀病毒(2019-nCoV)抗原檢測試劑注冊審查的相關(guān)要點。
01 監(jiān)管信息
01 產(chǎn)品名稱及分類編碼
產(chǎn)品名稱應(yīng)符合《體外診斷試劑注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第48號)及相關(guān)法規(guī)的要求,如新型冠狀病毒(2019-nCoV)抗原檢測試劑盒(膠體金法)。根據(jù)《體外診斷試劑分類規(guī)則》,該產(chǎn)品按照第三類體外診斷試劑管理,分類編碼為6840。
02 其他信息
包括產(chǎn)品列表、關(guān)聯(lián)文件、申報前與監(jiān)管機構(gòu)的聯(lián)系情況和溝通記錄以及符合性聲明等文件。
02 綜述資料
綜述資料主要包括概述、產(chǎn)品描述、預(yù)期用途、申報產(chǎn)品上市歷史及其他需說明的內(nèi)容。其中,產(chǎn)品描述中應(yīng)詳述檢測原理 、產(chǎn)品主要研究結(jié)果的總結(jié)和評價 、與同類和/或前代產(chǎn)品的比較等。與同類和/或前代產(chǎn)品的比較 ,應(yīng)著重從方法學(xué) 、檢驗原理、產(chǎn)品主要性能等方面詳細說明申報產(chǎn)品與目前市場上已獲批同類產(chǎn)品之間的主要區(qū)別。
03 非臨床資料
01 產(chǎn)品技術(shù)要求及檢驗報告
依據(jù)國家標準、行業(yè)標準及有關(guān)文獻資料,結(jié)合產(chǎn)品特性按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》(2022年第8號)的要求編寫。該類產(chǎn)品作為第三類體外診斷試劑,應(yīng)當(dāng)以附錄形式明確主要原材料以及生產(chǎn)工藝要求。
新型冠狀病毒抗原檢測試劑已有國家標準品,技術(shù)要求中應(yīng)體現(xiàn)國家標準品的相關(guān)要求,并使用國家標準品對三批產(chǎn)品進行檢驗。
02 分析性能研究
注冊申請人應(yīng)采用在符合質(zhì)量管理體系的環(huán)境下生產(chǎn)的試劑盒進行所有分析性能研究,可著重對樣本穩(wěn)定性、適用的樣本類型、精密度、包容性、檢出限、分析特異性、高劑量鉤狀效應(yīng)、反應(yīng)體系等分析性能進行研究,提交具體研究方法、試驗方案、試驗數(shù)據(jù)、統(tǒng)計分析等詳細資料。
03 穩(wěn)定性研究資料
穩(wěn)定性研究主要包括實時穩(wěn)定性(有效期)、開瓶(開封)穩(wěn)定性、高溫加速破壞穩(wěn)定性、運輸穩(wěn)定性等,注冊申請人可根據(jù)實際需要選擇合理的穩(wěn)定性研究方案。穩(wěn)定性研究資料應(yīng)包括研究方法的確定依據(jù)、具體的實施方案、詳細的研究數(shù)據(jù)以及結(jié)論。對于實時穩(wěn)定性研究,應(yīng)提供至少三批樣品在實際儲存條件下保存至成品有效期后的研究資料。
04 陽性判斷值研究
提交對申報試劑陰性/灰區(qū)/陽性等結(jié)果判斷的陽性判斷值(cut-off,CO)確定的研究資料,包括具體的試驗方案、人群及受試者樣本選擇、評價標準、統(tǒng)計學(xué)分析和研究數(shù)據(jù)等。建立陽性判斷值使用的樣本來源的選擇應(yīng)考慮到不同的地理區(qū)域、不同的感染階段和生理狀態(tài)等因素的影響。如果產(chǎn)品適用不同樣本類型,需要對所有樣本類型進行陽性判斷值的驗證。
05 其他資料
包括主要原材料研究資料、生產(chǎn)工藝的研究資料等。
04 臨床評價資料
該類試劑應(yīng)通過臨床試驗路徑進行臨床評價。臨床試驗應(yīng)符合《體外診斷試劑注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第48號)、《體外診斷試劑臨床試驗技術(shù)指導(dǎo)原則》(國家藥品監(jiān)督管理局通告2021年第72號)的要求,如相關(guān)法規(guī)、文件有更新,臨床試驗應(yīng)符合更新后的要求。
臨床試驗中應(yīng)重點關(guān)注產(chǎn)品臨床性能評價、可用性評價、結(jié)果判讀能力評價、境外臨床試驗數(shù)據(jù)的認可、臨床評價資料的形式要求。
05 產(chǎn)品說明書和標簽樣稿
產(chǎn)品說明書格式應(yīng)滿足《體外診斷試劑說明書編寫指導(dǎo)原則》的要求。產(chǎn)品說明書的所有內(nèi)容均應(yīng)與注冊申請人提交的注冊申報資料的相關(guān)研究結(jié)果保持一致。如某些內(nèi)容引用自參考文獻,則應(yīng)以規(guī)范格式對此內(nèi)容進行標注,并單獨列明參考文獻的相關(guān)信息。
醫(yī)療器械注冊咨詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295
!">YY/T 0127《口腔醫(yī)療器械生物學(xué)評價》部分內(nèi)容有更新!
??醫(yī)療器械環(huán)氧乙烷滅菌產(chǎn)品追加確認【關(guān)鍵要點】解析
連日來 這里提到的抗原試劑盒 目前列表里的產(chǎn)品都是通過應(yīng)急審批的方式投入市場的,據(jù)國家藥監(jiān)局2021年12月發(fā)布的《醫(yī)療器械應(yīng)急審批程序》第十四條:“對于應(yīng)急審批醫(yī)療器械,附條件批準上市的,醫(yī)療器械注冊證的有效期與注冊證注明的附帶條件的完成時限一致,原則上不超過1年。如注冊人完成附帶條件,可以在到期之日前申請辦理延續(xù)注冊,符合要求的給予延續(xù)注冊,注冊證有效期為5年?div id="4qifd00" class="flower right"> ? 點開注冊證詳情,備注欄里有“注冊證有效期為一年”的說明 接下來,通過新冠抗原試劑盒進行居家健康監(jiān)測也許會成為常態(tài),今天,我們就來聊一聊新型冠狀病毒(2019-nCoV)抗原檢測試劑注冊審查的相關(guān)要點。 產(chǎn)品名稱應(yīng)符合《體外診斷試劑注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第48號)及相關(guān)法規(guī)的要求,如新型冠狀病毒(2019-nCoV)抗原檢測試劑盒(膠體金法)。根據(jù)《體外診斷試劑分類規(guī)則》,該產(chǎn)品按照第三類體外診斷試劑管理,分類編碼為6840。 包括產(chǎn)品列表、關(guān)聯(lián)文件、申報前與監(jiān)管機構(gòu)的聯(lián)系情況和溝通記錄以及符合性聲明等文件。 綜述資料主要包括概述、產(chǎn)品描述、預(yù)期用途、申報產(chǎn)品上市歷史及其他需說明的內(nèi)容。其中,產(chǎn)品描述中應(yīng)詳述檢測原理 依據(jù)國家標準、行業(yè)標準及有關(guān)文獻資料,結(jié)合產(chǎn)品特性按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》(2022年第8號)的要求編寫。該類產(chǎn)品作為第三類體外診斷試劑,應(yīng)當(dāng)以附錄形式明確主要原材料以及生產(chǎn)工藝要求。 新型冠狀病毒抗原檢測試劑已有國家標準品,技術(shù)要求中應(yīng)體現(xiàn)國家標準品的相關(guān)要求,并使用國家標準品對三批產(chǎn)品進行檢驗。 注冊申請人應(yīng)采用在符合質(zhì)量管理體系的環(huán)境下生產(chǎn)的試劑盒進行所有分析性能研究,可著重對樣本穩(wěn)定性、適用的樣本類型、精密度、包容性、檢出限、分析特異性、高劑量鉤狀效應(yīng)、反應(yīng)體系等分析性能進行研究,提交具體研究方法、試驗方案、試驗數(shù)據(jù)、統(tǒng)計分析等詳細資料。 穩(wěn)定性研究主要包括實時穩(wěn)定性(有效期)、開瓶(開封)穩(wěn)定性、高溫加速破壞穩(wěn)定性、運輸穩(wěn)定性等,注冊申請人可根據(jù)實際需要選擇合理的穩(wěn)定性研究方案。穩(wěn)定性研究資料應(yīng)包括研究方法的確定依據(jù)、具體的實施方案、詳細的研究數(shù)據(jù)以及結(jié)論。對于實時穩(wěn)定性研究,應(yīng)提供至少三批樣品在實際儲存條件下保存至成品有效期后的研究資料。 提交對申報試劑陰性/灰區(qū)/陽性等結(jié)果判斷的陽性判斷值(cut-off,CO)確定的研究資料,包括具體的試驗方案、人群及受試者樣本選擇、評價標準、統(tǒng)計學(xué)分析和研究數(shù)據(jù)等 包括主要原材料研究資料、生產(chǎn)工藝的研究資料等 該類試劑應(yīng)通過臨床試驗路徑進行臨床評價 臨床試驗中應(yīng)重點關(guān)注產(chǎn)品臨床性能評價 產(chǎn)品說明書格式應(yīng)滿足《體外診斷試劑說明書編寫指導(dǎo)原則》的要求。產(chǎn)品說明書的所有內(nèi)容均應(yīng)與注冊申請人提交的注冊申報資料的相關(guān)研究結(jié)果保持一致。如某些內(nèi)容引用自參考文獻,則應(yīng)以規(guī)范格式對此內(nèi)容進行標注,并單獨列明參考文獻的相關(guān)信息。 醫(yī)療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295




