專注國(guó)內(nèi)外醫(yī)療器械咨詢服務(wù)
注冊(cè)認(rèn)證 · 許可備案 · 體系輔導(dǎo) · 企業(yè)培訓(xùn)
400-888-7587
0755-86194173
020-82177679
、13602603195四川:028-68214295
、15718027946湖南:0731-22881823
、15013751550列表
針對(duì)非預(yù)期醫(yī)療用途產(chǎn)品,歐盟又發(fā)布了新的指南文件!
文章出處:法規(guī)動(dòng)態(tài) 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2024-02-28
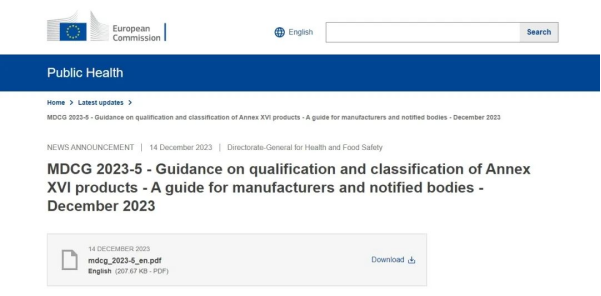
歐洲當(dāng)?shù)貢r(shí)間12月14日,歐盟發(fā)布MDCG 2023-5"Guidance on qualification and classification of Annex XVI Products",對(duì)MDR附錄十六中非預(yù)期醫(yī)療用途產(chǎn)品的界定及分類規(guī)則進(jìn)行了進(jìn)一步明確,這是一份專門針對(duì)制造商及公告機(jī)構(gòu)的指南文件,以便為他們?cè)诰唧w產(chǎn)品上市申報(bào)時(shí)提供更多參考。
關(guān)于此類產(chǎn)品的界定 如果附件產(chǎn)品只能與MDR附錄十六中的產(chǎn)品聯(lián)合使用 如果附件產(chǎn)品可以單獨(dú)使用或與其他MDR附錄十六中的產(chǎn)品聯(lián)合使用 如果制造商聲稱產(chǎn)品有醫(yī)療和非醫(yī)療兩種預(yù)期用途 原則上,每一種產(chǎn)品應(yīng)該只屬于MDR附錄十六所列的6組之一 不被列入非預(yù)期醫(yī)療用途產(chǎn)品目錄,不適用于CS的產(chǎn)品 除此之外,此次指南文件同時(shí)對(duì)非預(yù)期醫(yī)療用途產(chǎn)品分類規(guī)則的應(yīng)用進(jìn)行了解釋和實(shí)例說明 ↑ 部分實(shí)例說明