專注國內(nèi)外醫(yī)療器械咨詢服務(wù)
注冊認證 · 許可備案 · 體系輔導(dǎo) · 企業(yè)培訓(xùn)
400-888-7587
0755-86194173
、13502837139、19146449057020-82177679
、13602603195四川:028-68214295
湖南:0731-22881823
、15013751550列表
如何檢索醫(yī)療器械CE認證法規(guī)及標準
文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2019-08-28
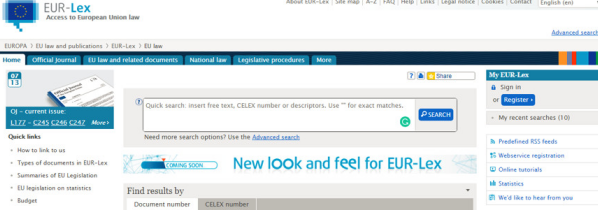
歐盟法規(guī)查詢
網(wǎng)址:https://eur-lex.europa.eu/homepage.html
簡介: EUR-Lex給公眾提供免費的歐盟法規(guī)(24種語言)的下載
界面: 請見下圖
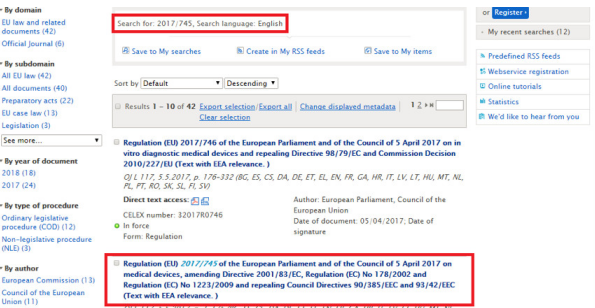
檢索舉例: 以查詢MDR法規(guī)為例
具體請見下圖
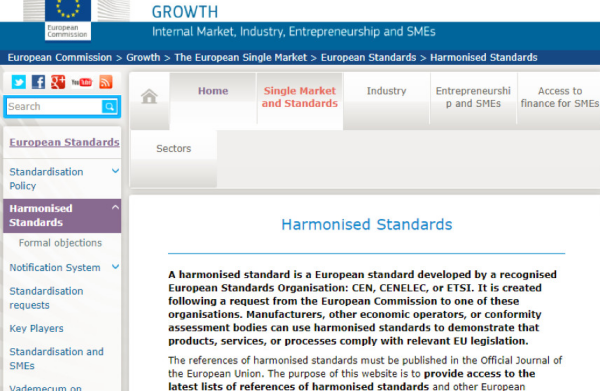
歐盟協(xié)調(diào)標準查詢
網(wǎng)址:https://ec.europa.eu/growth/single-market/european-standards/harmonised-standards_en
簡介: 該網(wǎng)站提供了歐盟所有指令下產(chǎn)品的協(xié)調(diào)標準的查詢途徑
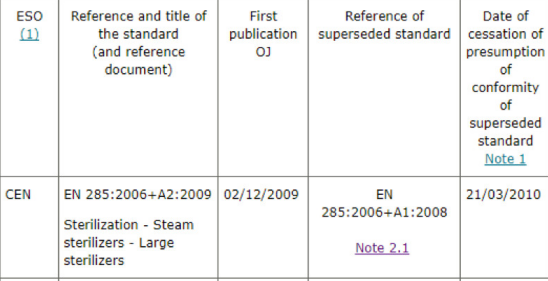
界面: 請見下圖
檢索舉例: 以查詢MDD產(chǎn)品的歐盟協(xié)調(diào)標準為例,下拉找到Healthcare engineering, 然后選中Medical device(MDD), 點擊你就會看到相關(guān)的協(xié)調(diào)標準
歐盟指南文件查詢
網(wǎng)址:https://ec.europa.eu/growth/sectors/medical-devices/guidance_en
簡介: 該網(wǎng)址提供了MDD, AIMD及IVDD相關(guān)指南文件的查詢途徑
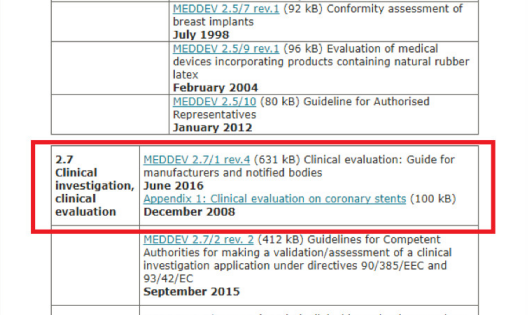
界面: 請見下圖

檢索舉例: 以檢索臨床評價的要求MEDDEV 2.7/1 Rev 4舉例,進入該網(wǎng)址后下拉點擊Guidance MEDDEVs, 下拉你就可以看到MEDEV 2.7/1 Rev 4這個文件了
公告機構(gòu)聯(lián)盟工作文件查詢
網(wǎng)址:http://www.team-nb.org/nb-med-documents/
簡介: 為了更好地開展醫(yī)療器械的CE認證工作,歐盟成員國的公告機構(gòu)成立聯(lián)盟
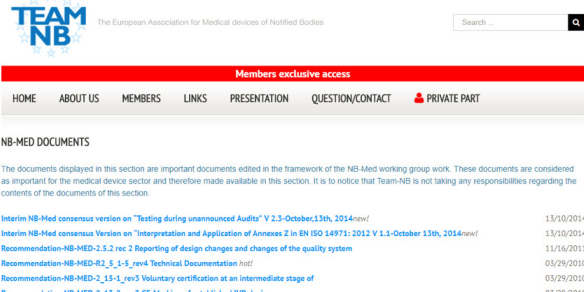
界面: 請見下圖。
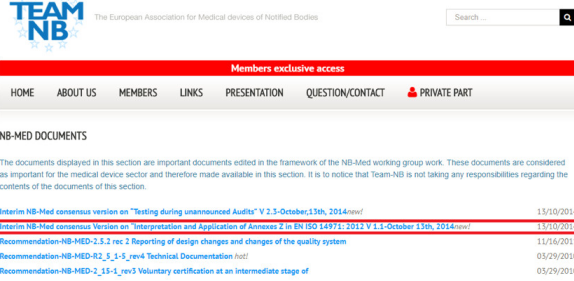
檢索舉例: 以檢索歐盟風(fēng)險管理差異審查文件為例(特別提醒一下廣大醫(yī)療器械廠商只是滿足ISO14971:2007 Corrected version的要求和歐盟的要求有較大差距)進入NB-MED document的界面后
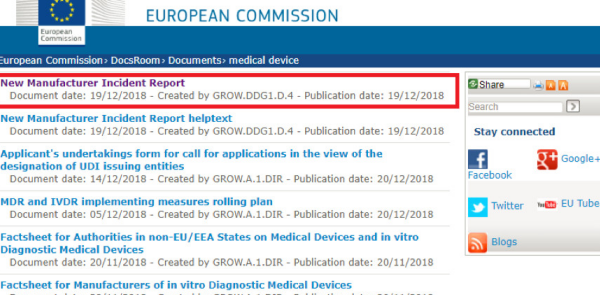
歐盟官方和醫(yī)療器械監(jiān)管相關(guān)的法規(guī)文件
網(wǎng)址: https://ec.europa.eu/docsroom/documents?locale=en&keywords=medical%20device
簡介:歐盟在官網(wǎng)上會定期公布一些和醫(yī)療器械監(jiān)管相關(guān)的文件
界面: 請見下圖。
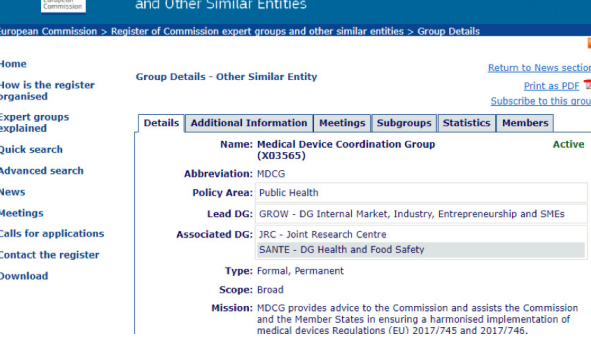
MDCG的文件
網(wǎng)址: http://ec.europa.eu/transparency/regexpert/index.cfm?do=groupDetail.groupDetail&groupID=3565&news=1
簡介: MDCG向委員會提供建議
界面: 請見下圖