專注國內(nèi)外醫(yī)療器械咨詢服務(wù)
注冊認證 · 許可備案 · 體系輔導(dǎo) · 企業(yè)培訓(xùn)
400-888-7587
0755-86194173
020-82177679、13602603195
四川:028-68214295、15718027946
湖南:0731-22881823、15013751550
列表
??官方指南丨一文說清創(chuàng)新醫(yī)療器械申報全流程
文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-11-08
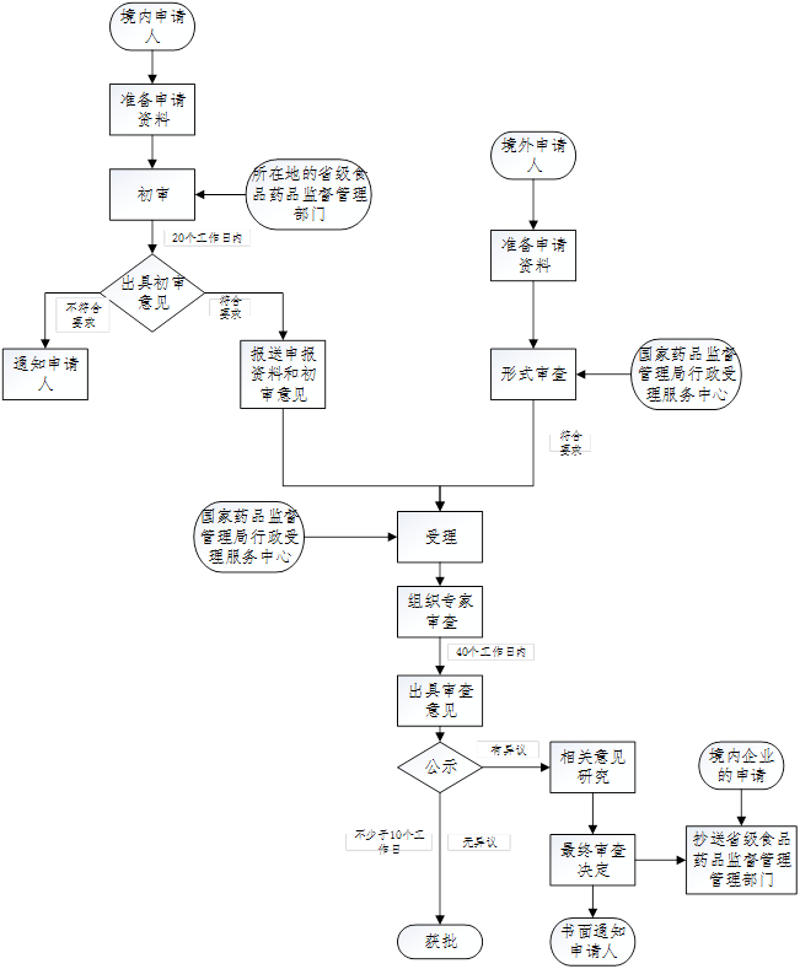
創(chuàng)新是醫(yī)療器械行業(yè)發(fā)展的核心動力,而高效 《醫(yī)療器械監(jiān)督管理條例》(國務(wù)院令第739號) 《醫(yī)療器械注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第47號) 《體外診斷試劑注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第48號) 國家藥監(jiān)局關(guān)于發(fā)布創(chuàng)新醫(yī)療器械特別審查程序的公告(2018年第83號) 關(guān)于發(fā)布創(chuàng)新醫(yī)療器械特別審查申報資料編寫指南的通告(2018年第127號) 關(guān)于發(fā)布醫(yī)療器械技術(shù)審評中心創(chuàng)新醫(yī)療器械特別審查申請審查操作規(guī)范的通告(2018年第11號) 關(guān)于發(fā)布創(chuàng)新優(yōu)先醫(yī)療器械注冊技術(shù)審評溝通交流操作規(guī)范的通知 1. 申請人通過其主導(dǎo)的技術(shù)創(chuàng)新活動,在中國依法擁有產(chǎn)品核心技術(shù)發(fā)明專利權(quán) 2. 申請人已完成產(chǎn)品的前期研究并具有基本定型產(chǎn)品 3. 產(chǎn)品主要工作原理或者作用機理為國內(nèi)首創(chuàng) 3.1 申報資料內(nèi)容要求 3.1.1 創(chuàng)新醫(yī)療器械特別審查申請表 產(chǎn)品名稱應(yīng)當(dāng)符合《醫(yī)療器械通用名稱命名規(guī)則》等文件相關(guān)規(guī)定 3.1.2 申請人企業(yè)資質(zhì)證明文件 (1)境內(nèi)申請人應(yīng)當(dāng)提交:企業(yè)營業(yè)執(zhí)照復(fù)印件。 (2)境外申請人應(yīng)當(dāng)提交:境外申請人注冊地所在國家(地區(qū))醫(yī)療器械主管部門出具的企業(yè)資質(zhì)證明文件 3.1.3 產(chǎn)品知識產(chǎn)權(quán)情況及證明文件 (1)提供產(chǎn)品核心技術(shù)知識產(chǎn)權(quán)情況說明。如存在多項發(fā)明專利 (2)提供相關(guān)知識產(chǎn)權(quán)情況證明文件 ① 申請人已獲取中國發(fā)明專利權(quán)的 ② 申請人依法通過受讓取得在中國發(fā)明專利使用權(quán)的,除提交專利權(quán)人持有的專利授權(quán)證書 ③ 發(fā)明專利申請已由國務(wù)院專利行政部門公開 3.1.4 產(chǎn)品研發(fā)過程及結(jié)果綜述 綜述產(chǎn)品研發(fā)的立題依據(jù)及已開展的實驗室研究、動物實驗研究(如有)、臨床研究及結(jié)果(如有),提交包括設(shè)計輸入、設(shè)計驗證及設(shè)計輸出在內(nèi)的產(chǎn)品研發(fā)情況綜合報告。 3.1.5 產(chǎn)品技術(shù)文件,至少應(yīng)當(dāng)包括: (1)產(chǎn)品的適用范圍/預(yù)期用途 ① 應(yīng)當(dāng)明確產(chǎn)品適用范圍/預(yù)期提供的治療、診斷等符合《醫(yī)療器械監(jiān)督管理條例》中有關(guān)醫(yī)療器械定義的目的,并描述其適用的醫(yī)療階段(如治療后的監(jiān)測、康復(fù)等); ② 說明產(chǎn)品是一次性使用還是重復(fù)使用; ③ 說明預(yù)期與其組合使用的器械(如適用); ④ 目標患者人群的信息(如成人、兒童或新生兒),患者選擇標準的信息,以及使用過程中需要監(jiān)測的參數(shù)、考慮的因素。 (2)產(chǎn)品工作原理或者作用機理 詳述產(chǎn)品實現(xiàn)其適用范圍/預(yù)期用途的工作原理或者作用機理,提供相關(guān)基礎(chǔ)研究資料。 (3)明確產(chǎn)品主要技術(shù)指標及確定依據(jù),主要原材料、關(guān)鍵元器件的指標要求,主要生產(chǎn)工藝過程及流程圖,主要技術(shù)指標的檢驗方法。 3.1.6 產(chǎn)品創(chuàng)新的證明性文件 (1)國內(nèi)核心刊物或國外權(quán)威刊物公開發(fā)表的能夠充分說明產(chǎn)品臨床應(yīng)用價值的學(xué)術(shù)論文、專著及文件綜述(如有) 可提供本產(chǎn)品的文獻資料,亦可提供境外同類產(chǎn)品的文獻資料 (2)國內(nèi)外已上市同類產(chǎn)品應(yīng)用情況的分析及對比 ① 提供境內(nèi)已上市同類產(chǎn)品檢索情況說明 ② 提供境外已上市同類產(chǎn)品應(yīng)用情況的說明。提供支持產(chǎn)品在技術(shù)上處于國際領(lǐng)先水平的對比分析資料(如有)。 (3)產(chǎn)品的創(chuàng)新內(nèi)容及在臨床應(yīng)用的顯著價值 ① 產(chǎn)品創(chuàng)新性綜述 闡述產(chǎn)品的創(chuàng)新內(nèi)容,論述通過創(chuàng)新使所申請醫(yī)療器械較現(xiàn)有產(chǎn)品或治療手段在安全、有效、節(jié)約等方面發(fā)生根本性改進和具有顯著臨床應(yīng)用價值。 ② 支持產(chǎn)品具備創(chuàng)新性的相關(guān)技術(shù)資料。 3.1.7 產(chǎn)品風(fēng)險分析資料 (1)基于產(chǎn)品已開展的風(fēng)險管理過程研究結(jié)果。 (2)參照《醫(yī)療器械 風(fēng)險管理對醫(yī)療器械的應(yīng)用》標準相關(guān)要求編寫。 3.1.8 產(chǎn)品說明書(樣稿) 應(yīng)當(dāng)符合《醫(yī)療器械說明書和標簽管理規(guī)定》(總局令第6號)的相關(guān)要求。 3.1.9 其他證明產(chǎn)品符合《創(chuàng)新醫(yī)療器械特別審查程序》第二條的資料 如產(chǎn)品或者其核心技術(shù)曾經(jīng)獲得過國家級、省部級科技獎勵,請說明并提交相關(guān)證明文件復(fù)印件。 3.1.10 所提交資料真實性的自我保證聲明 境內(nèi)產(chǎn)品申請由申請人出具,進口產(chǎn)品申請由申請人和代理人分別出具。 3.1.11 代理人相關(guān)資料 境外申請人應(yīng)當(dāng)委托中國境內(nèi)的企業(yè)法人作為代理人或者由其在中國境內(nèi)的辦事機構(gòu)提出申請,并提交以下文件: (1)境外申請人委托代理人或者其在中國境內(nèi)辦事機構(gòu)辦理創(chuàng)新醫(yī)療器械特別審查申請的委托書; (2)代理人或者申請人在中國境內(nèi)辦事機構(gòu)的承諾書; (3)代理人營業(yè)執(zhí)照或者申請人在中國境內(nèi)辦事機構(gòu)的機構(gòu)登記證明。 3.2 申報資料格式要求 1. 申報資料應(yīng)當(dāng)按本指南第一部分順序排列并裝訂成冊。 2. 應(yīng)當(dāng)有所提交資料目錄,包括申報資料的一級和二級標題。每項二級標題對應(yīng)的資料應(yīng)當(dāng)單獨編制頁碼。 3. 由申請人編寫的文件按A4規(guī)格紙張打印,字體大小適于閱讀。 4. 申報資料使用復(fù)印件的,復(fù)印件應(yīng)當(dāng)清晰并與原件一致,彩色圖片、圖表應(yīng)當(dāng)提供彩色副件。 3.3 其他 1. 申請人應(yīng)當(dāng)如實填寫《創(chuàng)新醫(yī)療器械特別審查申請表》的全部內(nèi)容。 2. 境內(nèi)創(chuàng)新醫(yī)療器械特別審查申請申報資料若無特別說明,均應(yīng)為原件,并由申請人簽章。“簽章”是指:企業(yè)蓋章,或其法定代表人 3. 進口創(chuàng)新醫(yī)療器械特別審查申請申報資料若無特別說明 4. 申報資料應(yīng)當(dāng)使用中文 5. 對于再次申請創(chuàng)新醫(yī)療器械特別審查的,需提供歷次申請受理號及審查結(jié)果,并提交產(chǎn)品變化情況及申報資料完善情況說明。若有申報資料原件已在歷次創(chuàng)新醫(yī)療器械特別審查申請時提交,可提供經(jīng)申請人簽章的復(fù)印件,同時申請人出具文件聲明該申報資料原件所在申報資料的受理號及位置。 6. 申請人申報時需同時提交申報資料的全部電子文檔并提交電子版與紙質(zhì)版一致性聲明。電子文件應(yīng)以PDF格式用U盤方式報送。 ↑ 來源:國家藥品監(jiān)督管理局醫(yī)療器械審評檢查中心網(wǎng)站 注:境內(nèi)申請人需經(jīng)申請人所在省級監(jiān)督管理部門初審;境外申請人直接向國家局提交申請。 北京市的境內(nèi)申請人在提交初審時,需將資料以郵寄方式提交至北京市藥品監(jiān)督管理局醫(yī)療器械注冊管理處(聯(lián)系電話:010-55527342)。 經(jīng)創(chuàng)新醫(yī)療器械審查辦公室審查,對擬進行特別審查的申請項目,應(yīng)當(dāng)在國家藥監(jiān)局器審中心網(wǎng)站將申請人、產(chǎn)品名稱予以公示,公示時間應(yīng)當(dāng)不少于10個工作日。對于公示內(nèi)容有異議的,應(yīng)當(dāng)對相關(guān)意見研究后作出最終審查決定。 創(chuàng)新醫(yī)療器械審查辦公室作出審查決定后,將審查結(jié)果通過國家藥監(jiān)局器審中心網(wǎng)站告知申請人。 審查結(jié)果告知后5年內(nèi),未申報注冊的創(chuàng)新醫(yī)療器械 注:經(jīng)審查擬同意進行特別審查的申請項目 1. 對于經(jīng)審查同意按《創(chuàng)新醫(yī)療器械特別審查程序》審查的創(chuàng)新醫(yī)療器械,申請人所在地省級藥品監(jiān)督管理部門應(yīng)當(dāng)指定專人 2. 對于創(chuàng)新醫(yī)療器械,醫(yī)療器械檢驗機構(gòu)在進行檢驗時 3. 對于創(chuàng)新醫(yī)療器械 4. 對于創(chuàng)新醫(yī)療器械 (1)重大技術(shù)問題 (2)重大安全性問題; (3)臨床試驗方案 (4)階段性臨床試驗結(jié)果的總結(jié)與評價 (5)其他需要溝通交流的重要問題。 5. 受理和舉報中心受理創(chuàng)新醫(yī)療器械注冊申請后,應(yīng)當(dāng)將該注冊申請項目標記為“創(chuàng)新醫(yī)療器械”,并及時進行注冊申報資料流轉(zhuǎn)。 6. 國家藥監(jiān)局器審中心對已受理注冊申報的創(chuàng)新醫(yī)療器械