列表
最新→歐盟理事會(huì)正式通過IVDR過渡期延期提案
文章出處:法規(guī)動(dòng)態(tài) 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2024-02-26
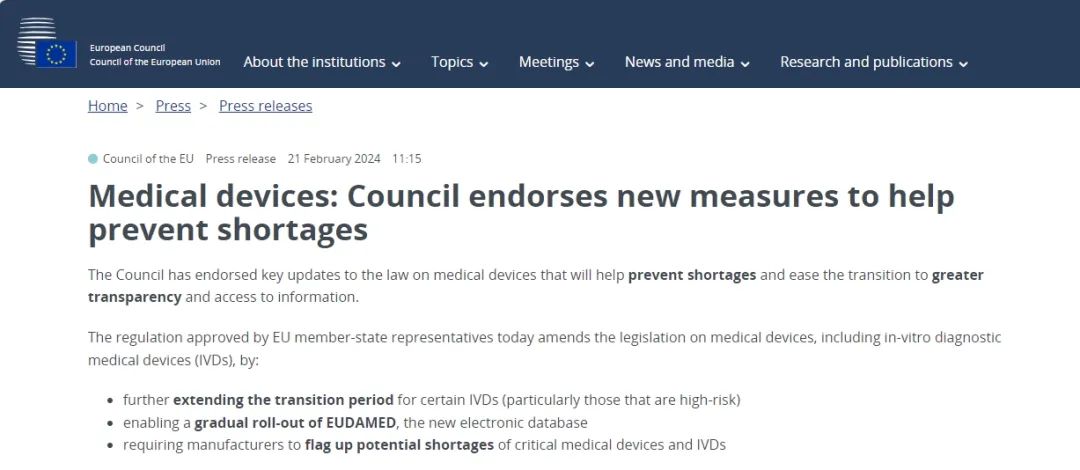
? 進(jìn)一步延長某些體外診斷器械(尤其是高風(fēng)險(xiǎn)體外診斷器械)的過渡期
? 逐步推出新的電子數(shù)據(jù)庫EUDAMED
? 要求制造商標(biāo)記關(guān)鍵醫(yī)療器械和體外診斷器械的潛在短缺
喜訊?div id="d48novz" class="flower left">
金飛鷹線下專題培訓(xùn)開始啦
最新一期專題培訓(xùn)主題丨醫(yī)療器械年度自查與不良事件上報(bào)
培訓(xùn)費(fèi)用:480元/人;金飛鷹合作企業(yè)報(bào)名2人及以上免收1人費(fèi)用(本次培訓(xùn)提供電子課程資料、證書等)。
有意者聯(lián)系:19925768195
? 時(shí)間:2024年3月9日(周六)9:30-17:00(8:30開始簽到)
1. 醫(yī)療器械不良事件的定義和分類
2. 上報(bào)的目的和意義
3. 與不良事件上報(bào)有關(guān)的法律法規(guī)要求
4. 不同市場(chǎng)主體(經(jīng)營企業(yè),醫(yī)療器械企業(yè),注冊(cè)人制度)上報(bào)的流程和渠道,包括網(wǎng)絡(luò)及書面填報(bào)等
5. 上報(bào)的時(shí)間要求和注意事項(xiàng)
6. 案例分析和討論,通過實(shí)際案例加深對(duì)上報(bào)的理解
7. 現(xiàn)場(chǎng)答疑和互動(dòng)交流
醫(yī)療器械企業(yè)管理代表、產(chǎn)品研發(fā)人員、產(chǎn)品注冊(cè)專員、檢驗(yàn)人員、質(zhì)量管理人員及其他感興趣的人員。
主辦單位:深圳市金飛鷹藥械技術(shù)咨詢有限公司
相關(guān)新聞
了解更多 +電話
400-888-7587
0755-86194173、13502837139
020-82177679
微信

微信公眾

小程序
郵箱
617677449@qq.com
