法規(guī)動態(tài)
您的位置:首頁新聞資訊法規(guī)動態(tài)

注冊認證 · 許可備案 · 體系輔導 · 企業(yè)培訓
400-888-7587
0755-86194173
020-82177679
四川:028-68214295
、15718027946湖南:0731-22881823
、15013751550您的位置:首頁新聞資訊法規(guī)動態(tài)
文章出處:法規(guī)動態(tài) 網(wǎng)責任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2019-08-28
體外診斷試劑產(chǎn)品注冊前期
,在健全并保證質量管理體系有效運行的前提下,企業(yè)已完成試劑的工藝驗證、性能驗證和穩(wěn)定性驗證后,應著手準備注冊檢驗及臨床試驗所需樣品,在這一階段中,企業(yè)需要思考的重點是擬申報試劑注冊檢驗和臨床試驗用的樣品量的問題,可以從以下幾方面進行考慮:1. 成品出廠檢驗量
按擬申報試劑的全性能測試所需要的量。
2. 留樣量
按照企業(yè)自定的留樣規(guī)程
,一般滿足全性能檢驗量的三倍3. 注冊檢驗用樣品量
根據(jù)各個檢驗機構的送檢量及各省份體外診斷試劑注冊檢驗抽樣規(guī)則來定
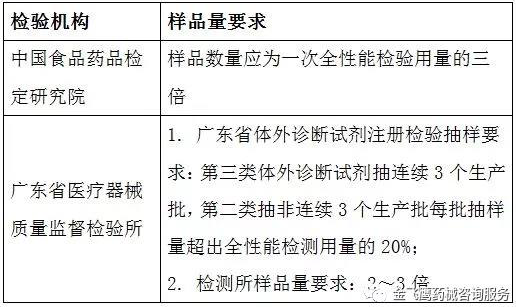
舉例:檢驗機構選擇中國食品藥品檢定研究院
1) 定義
主檢批次:一般用于全性能檢驗;副檢批次:一般是用來配合主檢批次進行批間精密度及穩(wěn)定性(如有)的檢測
2)樣品量計算
全性能檢驗(效期穩(wěn)定性除外)
某試劑企業(yè)
效期穩(wěn)定性檢驗(如有)
樣品在規(guī)定的貯存條件下保存至有效期后進行效期穩(wěn)定性檢測
4. 臨床試驗用樣品量
應根據(jù)《體外診斷試劑臨床試驗技術指導原則》中臨床試驗樣本量的要求以及臨床統(tǒng)計學的計算公式得出的樣品量進行準備
。著作權聲明:本文由深圳市金飛鷹企業(yè)管理顧問有限公司編制
,文中引用了政府的公開信息,轉載時請注明作者及出處。更多內容請關注金飛鷹公眾號
,我們將為您推送更多更好的關于醫(yī)療器械行業(yè)解讀文章。您也可以在底部留言你所想要了解的醫(yī)療器械問題,金飛鷹專業(yè)團隊將為您做針對性的原創(chuàng)解讀文章,以解君惑!